ВПЧ сам по себе не влияет на возможность женщины забеременеть, выносить и родить здорового ребенка. Но в человеческом организме все взаимосвязано, и одна проблема в большинстве случаев может привести к целому ряду других — работает «принцип домино». Поэтому в случае диагностированного вируса папилломы человека рекомендуется регулярно проходить иммунологические, гинекологические и онкологические обследования и лечиться.
По статистике до 30 процентов российских женщин репродуктивного возраста сталкиваются с вирусом папилломы человека (ВПЧ). Поэтому каждой будущей маме важно знать, как этот вирус может повлиять на возможность иметь детей.
Виктория Викторовна Залетова, главный врач клиники МАМА:
«Как забеременеть при ВПЧ? Можно ли забеременеть при ВПЧ?»
— спрашивают многие женщины.
Отвечаем:
принято считать, что вирус папилломы человека не влияет на репродуктивную функцию женщины. Сам по себе он действительно не оказывает никакого влияния на способность забеременеть, выносить и родить ребенка. Но ВПЧ зачастую — «вершина айсберга», под которой скрыто множество иммунных и гинекологических проблем.
Вирус папилломы человека, как и любой другой вирус, негативно воздействует на иммунную систему. Иммунитет ВПЧ-инфицированного постоянно находится в угнетенном состоянии, а это значит, что он в большей степени подвержен инфекционным заболеваниям, которые могут привести к самым разным последствиям.
Если говорить о беременности, то это — стресс для иммунной системы женщины. Эмбрион сочетает в себе клетки мамы («свои») и клетки папы «чужие»). Основная задача иммунной системы — как раз бороться с «чужими» клетками. Но беременность — исключение, организм подстраивается, иммунитет не работает в полную силу и принимает «чужака» на целые 9 месяцев.
При условии, что иммунная система в порядке. В случае нарушений ее работы возможно самопроизвольное прерывание беременности на ранних сроках. Причем сама женщина может не знать о своем положении, а ее организм уже отверг крошечного эмбриона. В таком случае речь идет об иммунном бесплодии. Помочь могут иммунолог и репродуктолог: они проведут анализы крови и рекомендуют лечение, которое позволит женщине стать мамой.
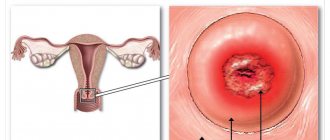
Вирус папилломы человека — фактор риска для развития онкологических заболеваний. Причем удар принимают женские репродуктивные органы: шейка матки и матка.
Существует около 40 типов ВПЧ, которые поражают слизистые оболочки половых органов и провоцируют гинекологические заболевания разной степени тяжести.
В ходе медицинских исследований установлено, что ВПЧ может вызывать доброкачественные поражения шейки матки и рак шейки матки (некоторые типы ВПЧ).
Исследования показали также, что определенные типы ВПЧ выявляются при цервикальных интраэпитальных неоплазиях (ЦИН) и ранних стадиях дисплазии.
Введение
Бесплодие является актуальной медицинской и социальной проблемой. В России каждая пятая семейная пара бесплодна [1]. При этом мужской фактор отвечает за половину из этих случаев. Это связано с прогрессивным снижением репродуктивной функции. Существуют многочисленные данные о негативном влиянии вирусов на состояние репродуктивной системы мужчин. В человеческой популяции широко распространены вирусы герпеса человека (ВГЧ) [2].
Герпесвирусы вызывают пожизненное инфицирование и являются причиной множества заболеваний, половина из которых имеет рецидивирующее течение. ВГЧ инфицированы от 95% до 100% населения, а в разные периоды жизни человек инфицируется хотя бы одним, а чаще — несколькими типами вирусов, относящимися к семейству герпесвирусов. Во второй половине жизни практически все люди имеют антитела к большинству ВГЧ [3]. 8 типов герпесвирусов патогенны для человека.
Собственные результаты
Нами было проведено исследование, в которое были включены 287 мужчин с хроническим простатитом / синдромом хронической тазовой боли IIIA, у 23 из которых имелось бесплодие. Диагнозы верифицировали согласно критериям Европейской урологической ассоциации [30].
Помимо стандартных диагностических процедур проводили детекцию ВГЧ 4–6 типов в пробах из уретры, секрета предстательной железы и эякулята.
При выявлении ВГЧ пациентам с бесплодием (группа 1) назначали валацикловир 1000 мг/сут в течение 3 мес. и препарат ВИФЕРОН® (интерферон α-2b в комплексе с антиоксидантами (витаминами Е и С)) в форме ректальных суппозиториев. Исходя из личного опыта авторов, пациентам была назначена следующая схема использования препарата: 3 млн МЕ 2 раза в день — 10 дней, затем 3 раза в неделю (также 2 раза в день) в течение последующих 3 нед. Контроль вирусной нагрузки проводили к концу 3-месячного лечения. Остальным пациентам, у которых не было обнаружено ВГЧ 4–6 типов (группа II), назначали левофлоксацин 500 мг на 30 дней, тамсулозин 0,4 мг — на 3 мес., суппозитории диклофенак 50 мг — на 10 дней.
Помимо ациклического нуклеозида, обладающего прямым антигерпетическим действием и назначаемого при терапии абактериального простатита, ассоциированного с герпесвирусами, был выбран ВИФЕРОН® как препарат, способный обеспечить долгосрочный антивирусный эффект. Препарат содержит интерферон α-2b, это человеческий рекомбинантный аналог вещества, вырабатываемого в любых клетках организма. Он обладает противовирусными, иммуномодулирующими, антипролиферативными свойствами, подавляет репликацию РНК- и ДНК-содержащих вирусов. Интерферон α-2b в клетках запускает последовательность реакций, приводящих к супрессии синтеза вирусных белков, сборки и выхода вирионов в межклеточный матрикс. Помимо влияния на протеиновый синтез, интерфероны обладают эпигенетической активностью, активируя сотни генов, играющих важную роль в антивирусной защите клетки [31]. Кроме того, интерферон α-2b лимитирует распространение вирусных частиц путем активации так называемого «стража генома» — белка p53, что ведет к апоптотической смерти инфицированной клетки [32]. Аскорбиновая кислота и α-токоферола ацетат, входящие в состав препарата, являются высокоактивными антиоксидантами, обладают противовоспалительным, мембраностабилизирующим, а также регенерирующим свойствами.
У 11 пациентов с выявленными герпесвирусами проводили электронно-микроскопическое исследование сперматозоидов (JEM 1400, JEOL, Япония).
Нами было отмечено, что из 103 пациентов с обнаруженными ВГЧ 4–6 типов у 8 имелось бесплодие (группа I), в то время как среди 184 пациентов без герпесвирусов инфертильность была верифицирована у 15 (группа II).
Из 24 урогенитальных проб от 8 пациентов группы I было получено 12 вирус-положительных проб: 7 — эякулят, 1 — мазки из уретры, 4 — секрет предстательной железы. ЦМВ и ВЭБ обнаружены в 4 и 3 образцах соответственно, включая образцы с сочетаниями 2 ВГЧ. Значительно чаще встречался ВГЧ-6 — суммарно в 7 образцах из всех 12. Медианная вирусная нагрузка герпесвирусов 4–6 типов составила 1770 копий на 100 000 клеток.
В результате противовирусного лечения к концу 3-го месяца контрольные исследования обнаружили вирус только у 5 из 8 пациентов группы I, у которых выявляли герпесвирусы в 5 биопробах. При этом медианная вирусная нагрузка в них снизилась до 48 копий на 100 000 клеток.
В результате терапии в течение 6 мес. после окончания лечения наблюдали наступление беременности у супруг 10 из 23 мужчин, которые распределились по группам следующим образом: 6 из 8 из группы I и 4 из 10 из группы II. Статистический анализ показал, что различия в частоте наступления беременности достигают достоверной значимости между группами I и II (значение критерия χ2 составляет 4,960, критическое значение χ2 при уровне значимости p=0,05 составляет 3,841, уровень значимости р=0,026).
Влияние курса противовирусной терапии оценивали также методом электронной микроскопии. Изучение сперматозоидов 11 пациентов с бесплодием показало, что если до лечения капсиды ВГЧ 4–6 типов обнаруживали у 8 пациентов, то после лечения у 4 из этих пациентов вирусные капсиды в сперматозоидах более не выявляли, а у 3 других пациентов количество сперматозоидов с капсидами в среднем уменьшилось более чем в 2 раза: с 12% до 5% инфицированных гамет в эякуляте (рис. 1).
Когда нужно начинать готовиться к оплодотворению?
Зачастую зачатие наступает спонтанно. В таких случаях мужчинам все равно нужно сдать ряд анализов. Самое главное выявить риски наследственных проблем по мужской линии. Если они имеются, то партнеры должны проконсультироваться у генетика, пройти генетический скрининг.
Если говорить об ответственном подходе к планированию семьи, то для мужчин подготовка к предполагаемому зачатию начинается минимум за 3 месяца. Такой срок выбран не случайно. Это связано с созреванием сперматозоидов, полный цикл которого составляет примерно трехмесячный период. Если за это время мужской организм подвергался негативному воздействию, то это отразится в анализе спермограммы.
Обследование для обоих партнеров
При подготовке к беременности сдают следующие анализы:
- исследование мочи — показывает степень функционирования почек. По наличию белка, лейкоцитов, гноя, эритроцитов в моче выявляют воспаление в мочеполовой сфере, гематурию;
- группа и резус-фактор — несовместимость родителей по крови приводит во время гестации к резус-конфликту, если этот показатель у ребенка не такой, как у матери. Это может плохо повлиять на саму беременность и на здоровье новорожденного. Проблема проявляется гемолитической желтухой. Состояние не опасно для жизни, если врачи знают об этом факте и могут вовремя провести коррекцию;
- анализ крови общий — позволяет выявить инфекционные процессы, анемию;
- биохимия крови — дает представление о работе внутренних органов;
- анализ на глюкозу — при повышенных или слишком низких значениях глюкозы проводится повторное исследование. Если оно также показало плохие результаты, то требуется проконсультироваться у эндокринолога;
- кровь на гепатит С, RV, ВИЧ, ТОРЧ-инфекции. Такие патологии, как краснуха, токсоплазмоз, цитомегаловирус, другие могут быть жизнеугрожающими для плода и матери;
- ФЛГ — показывает отсутствие очагов туберкулеза в легких. При подозрениях на патологию пациента направляют к фтизиатру. Туберкулез – высококонтагиозное инфекционное заболевание. Вынашивать и рожать с такой болезнью опасно. Даже если больна не беременная, а мужчина, который находится рядом с ней, то это представляет большую опасность. В этом случае требуется госпитализация, специальные анализы, продолжительное лечение. Только после выздоровления можно планировать продолжение рода;
- ЭКГ — показывает состояние сердечной деятельности.
Подготовка к анализам минимальная. Накануне вечером нельзя есть после 19:00, пить спиртное. Приходят в лабораторию, где проводится забор венозной крови, натощак. Мочу на анализ нужно принести с собой. Требуется собрать в стерильный контейнер не менее 50 мл. утренней мочи, желательно среднюю порцию. Если в общих анализах были обнаружены отклонения от нормы, то назначается дополнительная диагностика. Комплекс обследования подбирается в зависимости от выявленных нарушений.
Диагностика для мужчин
Если стандартные анализы нормальные, зачатие произошло успешно, то беременной супруге остается наблюдаться у гинеколога на протяжении гестационного срока. Но далеко не всегда получается забеременеть. В этом случае требуется проведение углубленных анализов. Их обязательно проходит и мужчина, поскольку почти в половине случаев причиной бесплодия служит мужской фактор. Чаще всего проблема заключается в нарушении сперматогенеза.
Мужчине при планировании беременности нужно сдать такие анализы:
- ПЦР-тест — берется уретральный мазок на наличие возбудителей, вызывающих ЗППП. При незапущенных формах ИППП достаточно устранить инфекцию для восстановления фертильности.
- Спермограмма — анализ спермы назначается при подозрениях на бесплодие. Он позволяет определить тип бесплодия, назначить лечение. В ходе диагностики оценивается качество гамет, их количество. Сдается анализ путем мастурбации в специально отведенном кабинете клиники. Сперму нужно собрать в маркированную емкость, сразу передать лаборанту .
- MAR-тест – морфология сперматозоидов по Крюгеру. Оценивается форма, размеры, целостность половых клеток. Анализ показывает такие аномалии, как отсутствие хвоста сперматозоида, двойная головка, удлиненная или укороченная форма сперматозоида. С такими отклонениями естественное зачатие маловероятно. Паре могут предложить экстракорпоральное оплодотворение или ЭКО с ИКСИ. Эти процедуры ВРТ дают высокие шансы на беременность, если женщина здорова.
- ТРУЗИ — сонография предстательной железы. Ультразвуковое исследование покажет простатит, новообразования. Например, аденома может вызвать механическую обструкцию семявыносящих путей. Удаление образования позволит нормализовать проход спермы по половым путям.
- Анализ жидкости предстательной железы — микроскопическое исследование секрета простаты позволяет обнаружить воспаление, оценить функцию железы.
- Анализ крови на гормоны — мужчина сдает материал для определения фолликулостимулирующего, лютеотропного гормонов, пролактина, андрогенов, гормоны щитовидной железы. Особенно важен показатель тестостерона. У женщин уровень гонадотропинов и гонадостероидов зависит от менструального цикла. Поэтому для анализа им назначается конкретный день.
От мужчин не требуется соблюдения строгих сроков. Они могут сдавать анализ в любой календарный день. Перед анализом 3-4 дня нельзя заниматься сексом, нужно избегать стрессов. По приходу в лабораторию следует отдохнуть, успокоиться. Стабильность гормонального фона зависит от эмоционального состояния. Взятие анализа при беспокойстве может дать недостоверные результаты. Есть такой тип бесплодия, как гормональный. Эти гормоны влияют на сперматогенез. Вовремя проведенная гормонотерапия поможет исправить ситуацию.
При планировании беременности обследование мужчин необходимо для:
- определения пригодности семенной жидкости для оплодотворения яйцеклетки;
- обнаружения возбудителей инфекций в репродуктивных и других органах;
- выявления генетических рисков при отягощенном анамнезе, а также для 40-летних и более.
Список анализов определяется для каждого конкретного случая.
Нормальные результаты спермограммы
Основные характеристики при анализе эякулята
Подготовка к беременности при инфекционной патологии репродуктивной системы женщин
Внедрение современных технологий в клиническую практику позволило расширить исследования и показать, что отрицательное воздействие факторов внешней среды на микрофлору макроорганизма ведет к разнообразной патологии как воспалительного, так и невоспалительного генеза. Несмотря на значительные успехи, достигнутые в диагностике, терапии и профилактике инфекций, передаваемых половым путем, их частота не имеет отчетливой тенденции к снижению. Последнее связано также с ростом иммунодефицитных состояний на фоне ухудшения экологической обстановки, неправильного питания, частых стрессов, фармакологического бума с бесконтрольным применением лекарственных средств, в первую очередь, антибиотиков и др. Чаще всего половая инфекция бывает обусловлена несколькими патогенными факторами — вирусами, микробами, грибами, простейшими, которые вызывают похожие по клиническому течению, но различные по патогенезу и методам лечения заболевания.
Участие в формировании воспалительных заболеваний органов малого таза, сопровождающихся не только дисбиозом влагалища, но и аналогичными изменениями со стороны желудочно-кишечного тракта и мочевыделительной системы; психоэмоциональные нарушения; формирование иммуно- и интерферонодефицитных состояний — вот далеко не полный перечень проблем, характерных для пациенток с урогенитальными инфекциями. Эти особенности одновременно являются предгравидарным фоном, который не в состоянии обеспечить развитие адекватных компенсаторно-приспособительных реакций, необходимых для гестационного процесса у большинства этих больных.
Однако работы, посвященные вопросам подготовки к беременности женщин с бактериальной и/или вирусной инфекцией, крайне малочисленны и направлены, как правило, на коррекцию отдельных звеньев патологического состояния.
Исходя из вышеизложенного, важнейшим и неотъемлемым этапом является правильная предгравидарная подготовка женщин. Поэтому проведение мероприятий по борьбе с инфекцией необходимо начинать до наступления беременности.
Этапы мероприятий по борьбе с инфекцией
1. Выявление у женщин следующих заболеваний:
- хронические воспалительные заболевания придатков и матки, эктопия шейки матки, частые рецидивирующие кольпиты;
- аномалии развития и хронические воспалительные заболевания органов мочевыделения, дизурические расстройства неустановленной этиологии;
- заболевания, передающиеся половым путем (герпес, цитомегаловирус, хламидиоз, микоплазмоз, уреаплазмоз, кандидоз и т.д.);
- хронические экстрагенитальные очаги инфекции с частыми рецидивами;
- склонность к частым острым респираторным вирусным инфекциям;
- нарушения репродуктивной функции (бесплодие, дисфункция яичников, самопроизвольные выкидыши, неразвивающиеся беременности);
- осложненное течение предыдущих беременностей, родов, послеродового периода (хроническая плацентарная недостаточность, хроническая гипоксия и/или задержка внутриутробного развития плода, преждевременные роды, антенатальная гибель плода, аномалии прикрепления и отделения последа, гнойно-воспалительные заболевания пуэрперия и т.д.);
- неблагоприятные перинатальные исходы (внутриутробная или неонатальная инфекция, гипотрофия или пороки развития новорожденного, нарушение процессов ранней неонатальной адаптации и/или последующего физического и нервно-психического развития ребенка).
2. Тщательное клинико-лабораторное обследование женщин группы риска для верификации генитальной или экстрагенитальной инфекции независимо от уровня поражения репродуктивной системы не менее, чем двумя современными методами лабораторной диагностики, исследованием иммунного и интерферонового статуса и др.
3. Проведение комплексного лечения, которое должно включать как этиотропные виды терапии (комплекс антибактериального или противовирусного лечения), так и лечение сопутствующих заболеваний.
4. Планирование и подготовка к беременности.
При выявлении герпес-вирусной инфекции, проводится ее лечение с последующей профилактикой рецидивов.
При генитальной герпетической инфекции, независимо от уровня поражения репродуктивной системы, показано проведение как базисной (противовирусной) терапии, так и лечение сопутствующих заболеваний.
Базисные виды лечения
Наиболее современным и эффективным противовирусным препаратом является валацикловир. Валацикловир представляет собой пролекарство — L-валиновый эфир ацикловира. После всасывания в кровь валацикловир почти полностью превращается в ацикловир под влиянием печеночного фермента валацикловир-гидролазы.
а) Образовавшийся ацикловир проникает в пораженные вирусом клетки, где под влиянием вирусного фермента тимидинкиназы превращается в монофосфат, затем — в дифосфат и активный трифосфат. Трифосфат ацикловира угнетает ДНК-полимеразу и тем самым нарушает репликацию ДНК вируса простого герпеса. Следовательно, высокая избирательность валацикловира в отношении тканей, пораженных вирусом, объясняется тем, что первый этап цепи реакций фосфорилирования опосредуется ферментом, вырабатываемым самим вирусом. Валацикловир назначают по 0,5 г 2–3 раза в день в течение 5–10 дней. Длительность и дозу препарата подбирают индивидуально с учетом формы и тяжести вирусного заболевания.
б) На фоне блокады репликации вируса — стимуляция неспецифической резистентности организма в зависимости от показателей иммунного и интерферонового статуса больных (препараты иммуноглобулина, индукторы интерферона, энзимотерапия и др.).
в) Одновременное или последовательное использование специфического противогерпетического иммуноглобулина по 3,0 мл внутримышечно 1 раз в 3–5 дней, на курс 5 инъекций.
г) Стимуляция специфической резистентности организма (при условии увеличения межрецидивного периода в 1,5–2 раза) герпетической вакциной по 0,25 мл внутрикожно в руку 1 раз в 3 дня (всего 5 инъекций), после чего перерыв в лечении 2 недели и затем еще 5 инъекций по 0,25 мл 1 раз в 7 дней. Курс ревакцинации — через 6 месяцев.
д) Местное применение специфических мазей (зовиракс, алпизарин, мегосин, бонафтон).
При диагностике цитомегаловирусной инфекции проводится этиотропная противовирусная терапия. Четких рекомендаций по профилактике и лечению ЦМВ-инфекции нет. Идеальный противовирусный препарат должен иметь высокую клиническую эффективность, селективность по отношению к вирусу, полную безопасность для организма человека, вирусоцидное действие. Из-за отсутствия в настоящее время препаратов, которые полностью отвечали бы вышеуказанным требованиям по отношению к ЦМВ, профилактика и лечение данной инфекции представляет определенные трудности. Обязательной является коррекция показателей иммунитета, интерферонового статуса.
При ЦМВ-инфекции рекомендуют проводить курсовую пассивную иммунизацию противоцитомегаловирусным иммуноглобулином по 3 мл внутримышечно 1 раз в 3 дня, на курс 5 инъекций. Более эффективен нормальный человеческий иммуноглобулин по 0,25 г/кг через день внутривенно капельно, 3 введения на курс. Можно назначать иммуномодуляторы (Т-активин, циклоферон, иммунофан), критерием их эффективности служит положительная динамика показателей клеточного звена иммунитета. Применяют также цитотект (в виде 10% раствора иммуноглобулина с высоким содержанием анти-ЦМВ IgG) внутривенно капельно по 2 мл/кг каждые 2 дня до 8–10 раз под контролем серологических показателей.
Перспективно использование интерферонов — виферона по 0,5–1 млн. МЕ 2 раза в день в ректальных свечах в течение 15–20 дней. В профилактику и лечение ЦМВ-инфекции целесообразно включать системную энзимотерапию (вобэнзим по 5 драже 3 раза в день или флогэнзим по 2–3 таблетки 3 раза в день за 30 мин до еды в течение 1–1,5 месяца). Помимо лечения герпес-вирусной инфекции, показано проведение дополнительной терапии. Лечение скрыто протекающего хронического воспалительного процесса в эндометрии (вирусно-бактериальной этиологии) должно проводиться на фоне базисной терапии и быть этиотропным и патогенетически обоснованным. Учитывая превалирование анаэробно-аэробных ассоциаций, а также мико-, уреаплазменной и хламидийной инфекций, показано использование антибиотиков широкого спектра действия.
При обнаружении урогенитального хламидиоза, микоплазмоза и уреаплазмоза назначают: спирамицин по 1 таблетке (3 млн. МЕ) 3 раза в день в течение 5–7 дней; джозамицин по 500 мг 3 раза в сутки в течение 5–7 дней; азитромицин по 1 капсуле (250 мг) 1 раз в день в течение 6 дней.
Этиотропную терапию при инфекционной патологии репродуктивной системы целесообразно сочетать с использованием антиоксидантов — аскорбиновой кислоты (витамин С) по 50 мг и витамина Е по 100 мг 3 раза в сутки. Возможно также использование эфферентных методов лечения (плазмаферез, эндоваскулярное лазерное облучение крови).
Особое внимание следует уделять восстановлению микроэкологии половых путей, так как к осложнениям гестационного периода и родов, связанным с различными нарушениями микроценоза влагалища, относят угрозу прерывания, самопроизвольные выкидыши, преждевременные роды, хориоамнионит, несвоевременное излитие околоплодных вод, рождение детей с малой массой тела, хронической гипоксией и/или признаками внутриутробной инфекции, в послеродовом периоде возникновение раневой инфекции родовых путей, эндометрита.
Нарушение микроценоза влагалища наиболее часто связано с бактериальным вагинозом и/или кандидозной инфекцией. По данным литературы, 75% женщин репродуктивного возраста имеют, по крайней мере, один эпизод вагинального кандидоза. В настоящее время известно 196 видов грибов рода Candida. Из них со слизистых оболочек человека выделяют более 27 видов. По сводным данным, Candida albicans обнаруживают в кишечнике у 20–50% здоровых людей, на слизистой оболочке полости рта — у 20–60%, во влагалище — у 10–17% небеременных женщин.
Вагинальный кандидоз у беременных встречается в среднем в 30–40% случаев. Перед родами этот показатель может достигать 44,4%. Цель лечения бактериального вагиноза и вагинального кандидоза – восстановить нормальную микрофлору влагалища, задержать рост микроорганизмов, несвойственных этому микроценозу. Существует множество препаратов и схем лечения дисбиозов влагалища. Однако нет оптимального препарата, который бы отвечал всем требованиям и имел стопроцентную эффективность.
При бактериальном вагинозе применяют следующие препараты: далацин вагинальный крем (2% вагинальный крем, содержащий 100 мг клиндамицина фосфата) 1 раз в сутки в течение 3 дней или тантум роза — вагинальный душ — 2 раза в сутки в течение 7–10 дней.
Препараты для лечения вагинального кандидоза подразделяются на следующие группы:
1. Антибиотики (нистатин, леворин, натамицин, амфотерицин В).
2. Имидазолы (клотримазол, кетоконазол, миконазол).
3. Триазолы (флуконазол (Дифлюкан, Фунголон), итраконазол).
4. Комбинированные препараты (полижинакс, клион Д, пимафукорт, макмирор комплекс).
5. Другие препараты (дафнеджин, иодатполивинилпироллидон, гризеофульвин, флуцитозин, нитрофунгин).
При острой форме вагинального кандидоза антимикотики назначают по 1 влагалищной свече (таблетке) 1 раз на ночь в течение 6 дней, а при рецидиве хронической инфекции — в той же дозировке в течение 9 дней. Одновременно соблюдается половой покой в течение 2–3 недель, проводится лечение супруга (местно 1% мазь канизона или другое противогрибковое средство).
Эволюция новых антимикотиков идет по пути разработки более коротких курсов лечения. В связи с этим, новая эра в лечении микозов началась с внедрения в клиническую практику одно– или двукратно применяемых пероральных противогрибковых препаратов, активным веществом которых является флуконазол. Один из таких препаратов — Фунголон, который является одним из наиболее эффективных и высокобезопасных противогрибковых препаратов, ввиду его метаболической стабильности, быстрого всасывания за счет хорошей растворимости, минимального влияния на ферментные процессы в печени.
Фунголон относится к классу триазольных соединений, которые угнетают биосинтез стеролов мембраны грибов, нарушают синтез эргостерола, в результате чего ингибируется рост грибов. Установлено, что препарат активен при микозах, вызываемых условно-патогенными (оппортунистическими) грибами, в том числе рода Candida. При этом фунголон избирательно действует на клетку гриба и в отличие от других антимикотических средств не оказывает влияния на метаболизм гормонов, не изменяет концентрацию тестостерона в крови у мужчин и содержание стероидов у женщин, что исключает развитие побочных реакций.
Препарат принимают однократно в дозе 100–150 мг. В случае отсутствия эффекта через 5 дней назначают повторную дозу — 100–150 мг. Особо следует подчеркнуть, что в отличие от других антибикотиков, однократный прием фунголона перорально позволяет достичь терапевтического эффекта в 90–100% случаев.
Санация очагов экстрагенитальной инфекции проводится с учетом чувствительности возбудителей к антибактериальным препаратам.
Планирование и подготовка к беременности возможны только при стойкой и длительной (более 6 месяцев) ремиссии герпес-вирусной инфекции, а также после устранения нарушений в репродуктивной системе с учетом основных факторов прерывания беременности. Важным условием правильной подготовки к беременности является нормализация иммунного и интерферонового статусов пациенток с использованием энзимотерапии. Так как практически любая инфекция сопровождается нарушением процессов энергетики и метаболизма на клеточном, тканевом и органном уровнях человеческого организма, предгравидарная подготовка должна также включать метаболическую терапию. При этом используют комплекс препаратов, стимулирующих биоэнергетические процессы в клетках и тканях — рибофлавин-мононуклеотид, липоевая кислота, пантотенат кальция, токоферола ацетат, рибоксин, оротат калия, пиридоксальфосфат, фитин, троксевазин.
Метаболическую терапию назначают в течение 7 дней с 2–3-недельным перерывом, в виде комплексов. Показана также поливитаминная терапия с комплексом микроэлементов. Проведение ранней диагностики, профилактики и лечения инфекционной патологии репродуктивной системы женщин до наступления беременности, прегравидарная подготовка и планирование беременности позволяют снизить частоту осложнений гестационного периода, тяжесть течения (частоту и длительность рецидивов) инфекционного процесса при беременности, предупредить тяжелые формы неонатальной инфекции, уменьшить перинатальную заболеваемость и смертность.
Блокада репродукции вируса простого герпеса в режиме эпизодической или супрессивной терапии. Применяют ацикловир по 0,2 г 5 раз в сутки в течение 5 дней при легком течении инфекции (обострения 1 раз в 6–8 месяцев) и по 0,2 г 4 раза в сутки в непрерывном режиме в течение 2–2,5 месяцев — при ее частых рецидивах (обострения 1 раз в 30–90 дней).